产品简介
- Bradford蛋白浓度测定方法,是常用的经典蛋白浓度检测方法,在酸性条件下,考马斯亮蓝G250染料能与蛋白质的碱性和芳香族氨基酸迅速结合,可通过检测溶液595nm处吸光值,计算蛋白质浓度,吸光值与蛋白质浓度在一定范围内有较好的线性关系。经典Bradford法与BCA法相比,可以兼容更高浓度的还原剂,并且检测速度极快,但却无法兼容蛋白提取时常用的去垢剂,而本试剂盒在保留Bradford法原有优点的同时,能够兼容各种常用去垢剂。
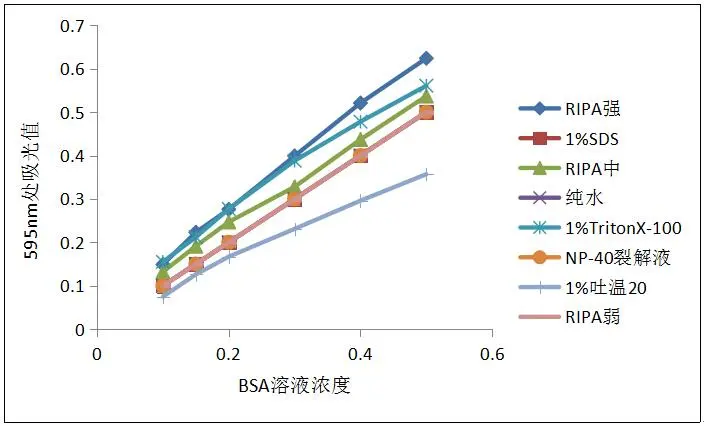
- 本试剂盒Bradford检测试剂溶液呈绿色,在与蛋白质结合后变为蓝色,颜色随蛋白浓度增加而逐渐加深。本试剂盒在测定蛋白质浓度时,可以兼容浓度1% SDS、1% NP-40、1% Triton X-100、1% Brij35和1% Tween 20等多种去垢剂,而且兼容我公司现有的所有蛋白裂解液。本试剂盒经过精心优化,可在上述去垢剂存在条件下,蛋白质样品或者标准品BSA浓度在0.1-0.5mg/ml范围内,标准曲线R2值可在0.995以上。
产品优势
- 兼容性好,可兼容常用去垢剂和蛋白裂解液
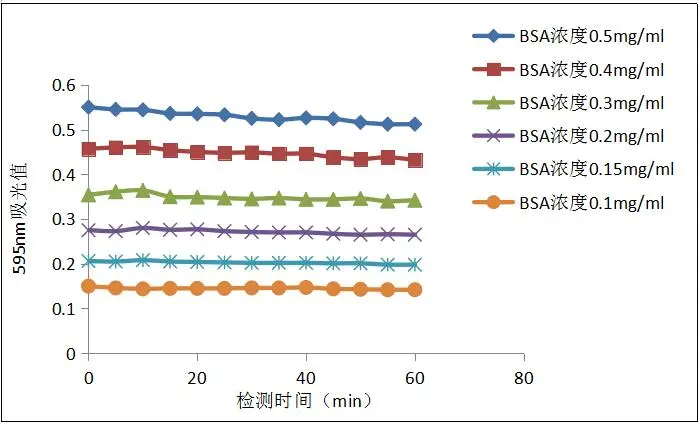
- 结果稳定,1小时内都可以进行检测
- 快速检测,5分钟即可完成蛋白定量时间
- 结果准确,线性相关性好,斜率高
实验数据
保存条件
4℃保存,一年有效。标准蛋白溶液BSA长期不用可放置在-20℃保存。
注意事项
- 当去垢剂浓度大于1%时,部分去垢剂和去垢剂组合仍然适用于Bradford蛋白定量试剂(去垢剂兼容型),但可能会出现斜率降低的现象,影响结果准确度。
- 本产品长时间不用会有少量沉淀产生,在使用前请将检测试剂上下翻转混匀。
- 本产品建议蛋白标准浓度范围是0.1-0.5mg/ml,如果因实验需要扩大蛋白标准浓度范围后出现标准曲线线性不好的现象,可将蛋白标准溶液和蛋白样品与检测试剂的体积比例改为5:300。
- 为了您的安全和健康,请穿实验服并戴一次性手套操作。
操作步骤
- 1.制备蛋白标准溶液
-
编号 稀释液体(ul) 蛋白标准溶液体积 最终浓度(mg/ml) 将20mg/mL的蛋白标准溶液按照上表进行稀释,注意在稀释时尽量保证蛋白标准溶液的稀释液与待检测蛋白样品的溶剂相同,在稀释时要保证每个浓度的标准蛋白溶液都充分混匀。以下表格内的体积适用于96孔酶标板测定,如使用分光光度计测定,按实际需要扩大溶液体积。 A 97.5 从蛋白标准溶液BSA取2.5ul 0.5 B 20 从A管取80ul 0.4 C 20 从B管取60ul 0.3 D 20 从C管取40ul 0.2 E 20 从C管取20ul 0.15 F 20 从D管取20ul 0.1 G 20 0 0 - 2.蛋白标准和蛋白样品浓度测定
- 1)取10ul上步骤已稀释好的不同浓度蛋白标准溶液依次加入到96孔酶标板中;
2)取10ul待测蛋白样品加入到96孔酶标板中。注意如蛋白样品浓度过大,需要用同蛋白标准稀释液相同的溶液稀释蛋白样品。
3)每孔加入300ul Bradford蛋白定量试剂(去垢剂兼容型)。用手轻弹酶标板混匀,室温放置3-5min,注意不可以使用酶标仪震板功能,防止液体洒出污染机器。
4)设置酶标仪测定595nm的吸光值,以不含BSA的吸光值做为空白对照。
5)以蛋白标准液的浓度为横坐标,吸光值为纵坐标,绘制标准曲线,注意将零点去除,得出标准曲线线性公式及R2值。
6)按照上述步骤所得公式,根据所测得的蛋白样品吸光值,计算蛋白样品的浓度。
7)如使用分光光度计测定,可根据实际需要扩大溶液体积,保证蛋白标准溶液和蛋白样品与Bradford蛋白定量试剂的体积比为10:300,例如,如果需要1.5ml,可取蛋白样品50ul,Bradford蛋白定量试剂1.5ml。

