产品内容:
| 产品组成 | 100T | 1000T |
| Cell Lysis Buffer (5x) | 10mL | 30mL |
| Firefly LuciferaseReaction Buffer | 10mL | 100mL |
| Firefly Luciferase Substrate | 1 vial | 1 vial-L |
| Stop &RenillaReaction Buffer | 10mL | 100mL |
| RenillaLuciferaseSubstrate(50x) | 200uL | 1mLx2 |
| 说明书 | 1份 | 1份 |
产品简介:
- 报告基因系统广泛应用于真核生物基因表达和细胞生理学研究,包括受体活性、转录因子、细胞信号转导、mRNA加工和蛋白质折叠等。“双报告基因”通常被用来提高实验精确度,即在一个系统中同时表达和测量两个独立的报告基因。一般来说,实验组报告基因与具体实验条件的影响是相关的,而共同转染的内对照组报告基因则是用来充当校正参数,作为内参提供反应基线。将实验组的结果与内对照组的结果进行约化处理,可降低由细胞存活率或转染效率的差异而导致的结果波动,同时还可消除由取样体积、细胞裂解效率和仪器测定引起的实验误差。因此,双报告基因检测可以通过减少外部影响来获得更可靠的实验数据。
- 美仑双萤光素酶报告基因检测试剂盒(Firefly&Renilla Luciferase Reporter Assay Kit)提供了一种有效的双报告基因检测方法,在同一个样品中先以萤光素(Luciferin)为底物来检测萤火虫萤光素酶(Firefly luciferase),后以腔肠素(Coelenterazine)为底物来检测海肾萤光素酶(Renilla luciferase),同时淬灭Firefly luciferase的萤光信号,实现双萤光素酶报告基因检测。该试剂盒可灵敏高效的检测受基因元件调控的Luciferase表达,通常将转录调控元件或5’启动子区克隆在Firefly luciferase的上游,或把3′-UTR区克隆在Firefly luciferase的下游,构建成报告基因(reporter gene)质粒。将报告基因质粒(Firefly)和内参质粒(Renilla)共转染细胞,经给药刺激等操作完毕后,裂解细胞并测定萤光素酶活性。通过萤光素酶活性的高低来判断药物处理对目的基因的转录调控作用。Renilla luciferase作为校正转染效率的内参可以消除细胞数量和转染效率的差异。萤火虫萤光素酶催化Luciferin发光的最强发光波长为560nm。海肾萤光素酶催化Coelenterazine发光的最强发光波长为465nm,具体波段选用需依据实验需求和所用仪器进行设定,通常采用全波段接收发射信号即可,不必单独设置。
反应原理如下:
数据展示
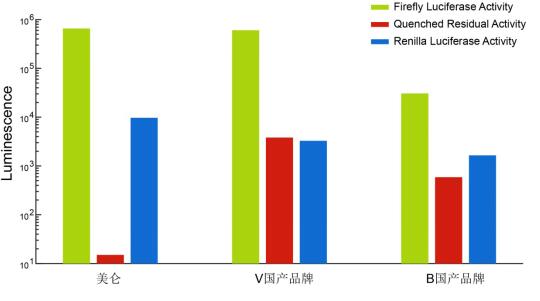
图1. 萤火虫萤光素酶发光强度、淬灭效果以及海肾萤光素酶发光强度对比。由图可知,各组间Firefly luciferase/ Renilla luciferase浓度和比例相同的前提下,美仑组的发光强度高于国产品牌。更为重要的是,美仑组的Firefly luciferase 淬灭效果最佳,远超国内其他品牌,荧光残留量仅为0.001%!几乎完全不影响Renilla再发光,因而具有最高的Renilla 信噪比,使得测试结果更加准确,数据可重复性提高!而其他国产试剂Firefly萤光淬灭很差,背景很高,直接影响Renilla读值。(仪器:BioTek HTX)
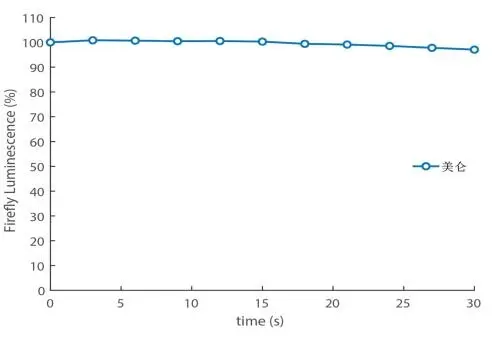
图2. 美仑Firefly luciferase萤光信号稳定性(动力学)检测。从反应初始时刻持续追踪Firefly luciferase萤光信号30s,可以发现美仑组的萤光信号近乎无衰减,信号稳定性极好,远远满足常规机器操作所需时长!(仪器参数:VILBER/化学发光/-90制冷CCD)
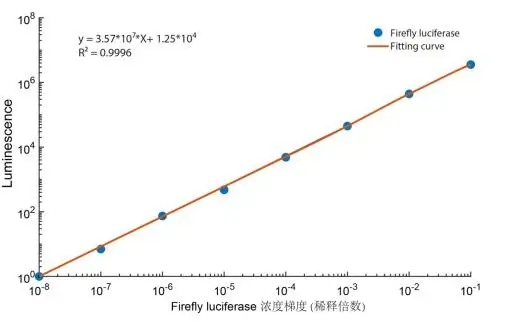
图3. 美仑组Luminescence-Firefly luciferase浓度梯度标准曲线。在仪器(BioTek HTX)允许的最大测试范围内,美仑Firefly luciferase 萤光线性检测范围可达8个数量级,R2可达0.9996!(仪器:BioTek HTX)
| TNFa | 20ng/ml | 10ng/ml | 5ng/ml | 2ng/ml | 0ng/ml |
| Firefly:Lum | 1835882 | 952348 | 193674 | 44991 | 43038 |
| Renilla:Lum | 21336 | 29067 | 24360 | 25063 | 26178 |
| Firefly/Renillaratio | 86.046 | 32.763 | 7.950 | 1.795 | 1.644 |
| Firefly/Renilla normalized | 52.336 | 19.928 | 4.835 | 1.091 | 1.000 |
图4. 美仑双萤光素酶报告基因检测试剂盒实际应用举例。HEK-293T细胞共转染了萤火虫萤光素酶NF-κB response reporter 和海肾萤光素酶内参质粒。转染后12h,进行TNFα浓度梯度诱导,5h后收集细胞并进行裂解。酶标仪检测双酶的信号读值,对数据进行约化和归一化处理,详见表格。上图为Firefly/Renilla约化数据折线图,可以明显看出Firefly/Renilla ratio 与给药浓度呈正相关,符合预期,并且梯度间变化显著,提示美仑双萤光素酶报告基因检测试剂盒灵敏度高!(仪器:BioTek HTX)
使用说明:
1、自备材料
PBS溶液;移液器或排枪;黑色酶标板;化学发光仪或酶标仪,可配自动进样器。
2、检测前准备
(1)首次使用时,将Firefly Luciferase Reaction Buffer一次性全部倒入Firefly Luciferase Substrate瓶中,涡旋震荡,底物充分溶解并混匀后按单次实验需求量进行适当分装,避光保存于-70℃,避免反复冻融。
(2)每次使用前以1:4比例将Cell Lysis Buffer(5x) 与ddH2O充分混合,置于冰上备用。配制体积根据实验需求,建议现配现用。
(3)使用时将RenillaLuciferaseSubstrate(50x) 于冰上避光暂存,计算实际使用量,以50:1的比例将适量的Stop &RenillaReaction Buffer与RenillaLuciferaseSubstrate混匀,室温避光备用。建议现配现用,剩余的反应液当次实验结束后,直接舍弃,不要留存。
3、操作方法
(1)单管检测方法
- 裂解细胞
- 贴壁细胞:吸去细胞培养基,用PBS缓慢轻柔地洗涤一次,洗去残留的培养基,然后将液体全部吸弃。悬浮细胞:离心去上清后,清洗细胞一次再次离心收集细胞沉淀。
- 按照下表推荐加入适量的1×Cell Lysis Buffer,室温下静置或振动摇晃裂解15min,吹打并吸取全部细胞裂解产物至1.5mL离心管中,16000g离心5min,取上清用于后续检测。
Cell Culture Plate 6-well 12-well 24-well 48-well 96-well 1×Cell Lysis Buffer 500uL 200uL 100uL 50uL 20uL 注:若萤光素酶的表达水平过低,可适当减少细胞裂解液用量以提高蛋白浓度,但需保证裂解液体积可以覆盖细胞孔板底面否则会影响裂解效果。
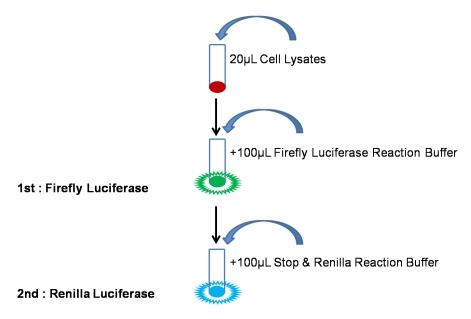
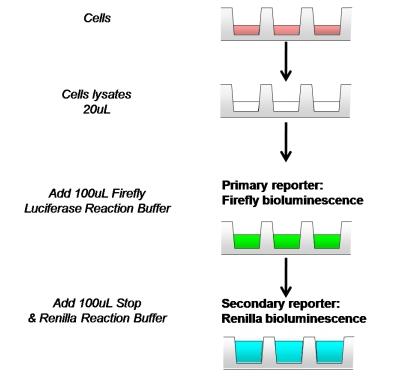
- Firefly Luciferase反应检测
小心吸取20uL细胞裂解上清依次加入至检测管或酶标板中,再加入100uL平衡至室温的含有底物的Firefly LuciferaseReaction Buffer,迅速混匀后立即于化学发光仪或酶标仪中检测Firefly Luciferase报告基因活性。(注:务必将反应缓冲液恢复至室温,使酶促反应在最适温度25℃进行。加样后,需要进行混匀,使酶促反应充分稳定进行。本品Firefly 萤光稳定性可达30s以上。) - Renilla Luciferase反应检测
在以上反应液中加入100uL现配制的Renilla检测工作液迅速混匀后立即于化学发光仪或酶标仪中检测Renilla Luciferase报告基因活性。
(2)通过自动进样器进行高通量检测方法
- 裂解细胞
- 贴壁细胞:用排枪吸去细胞培养基,PBS缓慢轻柔地洗涤一次,洗去残留的培养基,然后将液体全部吸弃。悬浮细胞:参考单管检测细胞收集方法,不适合原位裂解。
- 以96孔板为例,用排枪每孔加入20uL 1×Cell Lysis Buffer,室温下静置或振动摇晃裂解15min。
- 双酶反应检测
按照仪器说明书完成自动进样器的初始化操作,设定自动进样器1为溶解底物后的Firefly LuciferaseReaction Buffer;自动进样器2为加入底物的Stop&RenillaReaction Buffer。设置检测程序,通过自动进样器1加入100uL平衡至室温的含有底物的Firefly LuciferaseReaction Buffer,振板1-2s混匀,检测Firefly Luciferase报告基因活性。通过自动进样器2加入100uL的Renilla检测工作液,振板1-2s混匀,检测Renilla Luciferase报告基因活性。以此程序完成96孔板的所有样品检测。(注:务必将反应缓冲液恢复至室温,使酶促反应在最适温度25℃进行。加样后,需要进行振板混匀,使酶促反应充分稳定进行。本品Firefly 萤光稳定性可达30s以上。)
注意事项:
- 检测仪器选择:能够检测化学发光的仪器都适用本试剂盒的检测,但是针对相同的样品,不同检测器本底信号值和测量值均可能不同,且对于同一样本检测,不同仪器的数值不可横向比较。为防止孔间干扰,推荐使用黑色酶标板。本产品支持配有自动进样器的酶标仪,可以更好的减小人为操作时间造成的孔间差异,具体操作请参考配套的自动进样器说明书。
- 如果体系中萤光素酶表达量较低,可适当减少裂解用量以提高蛋白浓度,同时应增加检测复孔的数量,以减少低浓度表达造成的孔间差异,确保结果的可靠性。
- 酶促反应对温度较为敏感,加样检测前务必将细胞裂解产物和检测底物均平衡至室温后使用。
- 为保证萤光素酶检测试剂稳定性,可采取适当分装后-70℃冰箱避光保存的方法,以避免反复冻融和长时间暴露于室温。检测前根据需要取适量分装后的反应溶液室温(25℃)水浴复融,充分涡旋混匀后使用。
- 裂解产物与Firefly发光反应液接触后约30s内萤光强度较为稳定,为取得最佳检测结果,在使用单管的化学发光仪检测时,不同样品和底物混合后至上机检测的时间间隔应尽量一致;使用具有化学发光测定功能的多功能酶标仪时,应先把细胞裂解液在孔内加好,然后采用排枪统一加入检测底物并尽快上机检测。
- 加入Stop &RenillaReaction Buffer后对于萤火虫萤光素酶的抑制可以达到99.999%以上,建议通过以下方法提高淬灭效果:使用单管的化学发光检测仪时,加入抑制缓冲溶液后可缓慢吹打混匀2-3次即可(切勿吹起大量气泡);使用多功能酶标仪时,可通过增加混匀振幅或延长振动时间(1-2s)。
- 使用配有自动进样器的多功能酶标仪进行高通量检测时,注意选择合适的进样速度。加入Firefly LuciferaseReaction Buffer应选择低速模式,避免形成大量气泡;加入Stop &RenillaReaction Buffer可以选择略高一些的中速模式,有助于液体充分混匀达到更好的淬灭效果。
保存条件:
全新试剂盒-20℃保存,一年有效;
溶解分装后的Firefly Luciferase Substrate于-70℃避光保存一年,或-20℃短期保存不超过一个月。
运输条件:
干冰运输。
-
Acta Pharmaceutica Sinica B
IF:14.903
年份:2023
-
Acta Pharmaceutica Sinica B
IF:11.41
年份:2021
-
Journal of Advanced Research
IF:11.4
年份:2024
-
Journal Of Experimental & Clinical Cancer Research
IF:11.161
年份:2021
-
Environment International
IF:10.3
年份:2024
-
Science of The Total Environment
IF:9.8
年份:2023
-
Acta Biomaterialia
IF:9.4
年份:2024
-
Journal of Neuroinflammation
IF:9.3
年份:2023
-
Cellular & Molecular Biology Letters
IF:8.3
年份:2023
-
Cell Reports
IF:7.5
年份:2024
-
Frontiers in Cell and Developmental Biology
IF:6.684
年份:2020
-
Int J Biol Sci.
IF:6.583
年份:2021
-
Frontiers in Endocrinology
IF:5.551
年份:2021
-
Translational Oncology
IF:4.5
年份:2024



