产品简介:
高斯萤光素酶报告基因检测试剂盒(辉光型稳定版)提供一种高信号稳定性的检测系统,具有高灵敏度和发光信号稳定的特点,半衰期最长可达7小时以上,符合高通量检测的需求。同时高斯荧光素酶(Gaussia Luciferase,185 AA,19.9 kDa)是一种分泌型萤光素酶,Gaussia Luciferase 质粒转染细胞后,大部分 Gaussia Luciferase 可以分泌到细胞外,所以本试剂盒既可以用于细胞培养上清样品的检测,也可以用于细胞裂解样品或纯化的酶的检测,特别适用于酶活性的实时研究。
Gaussia Luciferase 产生的生物发光信号原理是腔肠素(Coelenterazine)的氧化反应,该反应不需要ATP或其他辅助因子。
反应原理如下:
注意事项:
1.检测仪器选择:能够检测化学发光的仪器都适用本试剂盒的检测,但是针对相同的样品,不同检测器本底信号值和测量值均可能不同;且对于同一样本检测,不同仪器的数值不可横向比较。为防止孔间干扰,推荐使用不透明白色或黑色细胞培养板。
2.由于发光信号会受到检测环境如培养基组分、温度等影响,所以应确保同组内不同样本检测条件一致。
3.酶促反应对温度较为敏感,加样检测前务必将检测工作液以及细胞培养板平衡至室温。
4.如需同时检测多个细胞培养板,请尽量确保每个细胞板加入检测溶液后孵育时间一致,再进行数据读取,以此获得最佳的检测结果。
5.高斯萤光素酶报告基因检测试剂盒(辉光型稳定版)具有超强信号稳定性,半衰期可达7小时以上。但是当酶表达量过高时,信号半衰期会缩短,建议优化实验设计方案(如减少质粒转染量),避免萤光素酶表达量过高。
6.Gaussia Glow-Stable Assay Substrate (100×) 配制在无水乙醇中。由于无水乙醇容易挥发,有时会在初次使用时发现体积明显小于包装规格的情况,此时用无水乙醇把体积补足至包装规格,并混匀后即可使用。
保存条件:
-20℃避光保存,自生产之日起12个月有效。
运输条件:
干冰运输。
产品数据展示:
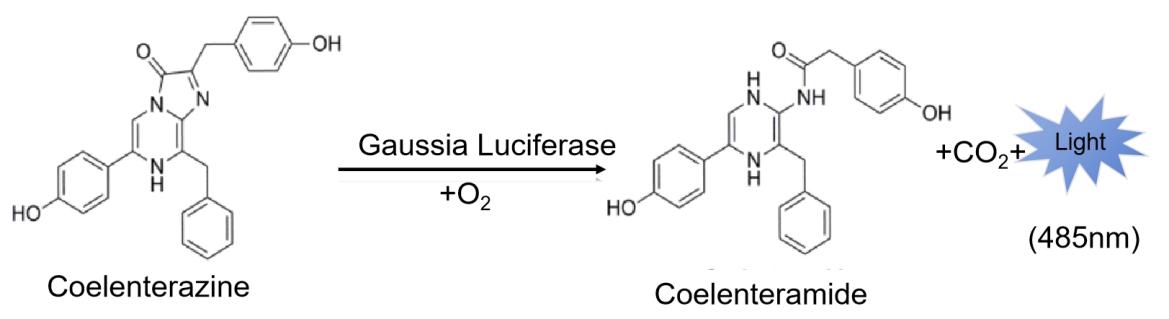
- GaussiaGlow-Stable Assay 发光稳定性及线性检测
方法:将Gaussia萤光素酶载体瞬时转入HEK293T细胞,24小时后收集培养上清,分别使用PWL211及G品牌同类产品,正常使用量(样品20μL+工作液50μL)及减半使用量(样品20μL+工作液25μL)检测发光情况。
结果:PWL211的发光亮度高于G进口品牌,且稳定性与G进口品牌接近。PWL211减半使用发光亮度增加。PWL211线性关系良好。
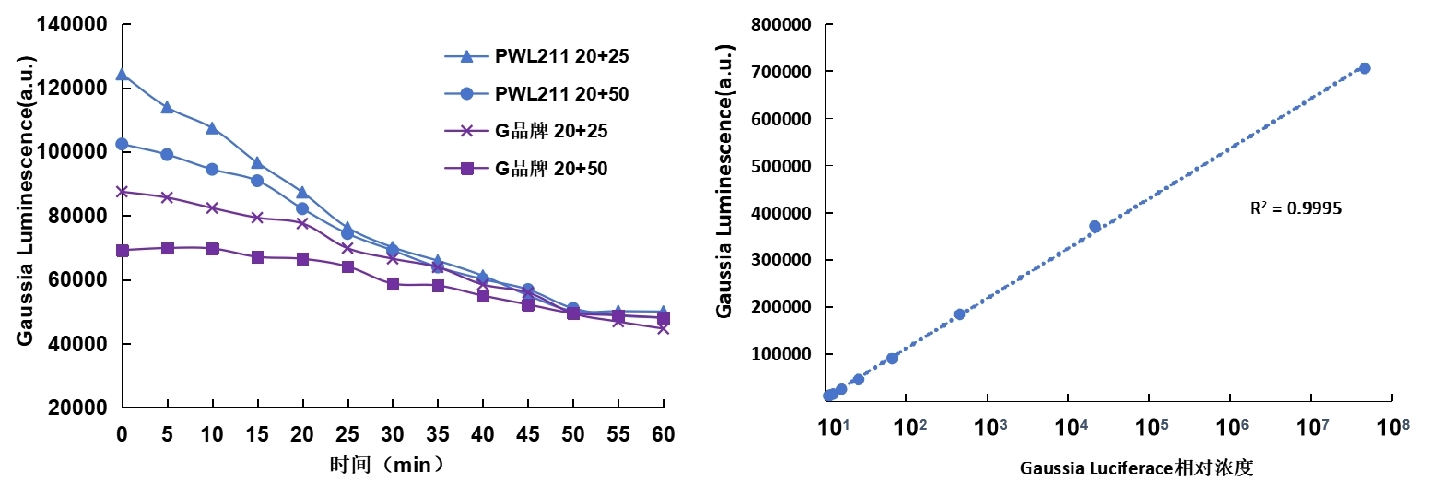
图1. Gaussia萤光素酶发光强度及线性检测
- 多种细胞中Gaussia萤光素酶的检测情况
①细胞培养上清检测
方法:将Gaussia萤光素酶载体分别瞬时转入HEK293T、Vero、HCT116、CHO-K1细胞中,24小时后收集培养上清,使用PWL211检测发光情况。
结果:PWL211可以在不同细胞上清中检测Gaussia萤光素酶活性,且Gaussia萤光素酶在HEK293T细胞中表达量最高。
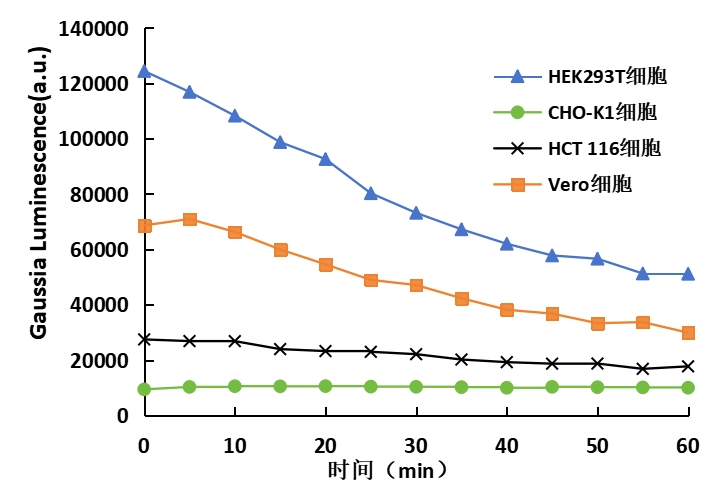
图2. 多种细胞上清中Gaussia萤光素酶的检测情况对比图
②总高斯萤光素酶活性的快速检测
方法:使用不透光白板/黑板,将Gaussia萤光素酶载体分别瞬时转入HEK293T、Vero细胞中,24小时后向孔板内加入与培养基等体积的PWL211工作液(培养基25μL+工作液25μL;培养基50μL+工作液50μL;培养基100μL+工作液100μL),室温孵育10min,检测发光情况。
结果:PWL211可直接检测细胞总高斯荧光素酶活性,且随着检测体系量增加,发光亮度明显提高。
图3. 多种细胞中Gaussia萤光素酶的检测情况对比图
左图:HEK293T细胞;右图:Vero细胞
- Gaussia萤光素酶稀释后检测
方法:将Gaussia萤光素酶载体分别瞬时转入HEK293T、Vero细胞中,24小时后收集培养上清,用DMEM培养基梯度稀释50倍、100倍和200倍,使用PWL211检测发光情况,结果以稀释50倍的检测发光亮度为100%计算。
结果:Gaussia萤光素酶稀释50倍、100倍、200倍时,PWL211检测发光亮度无明显变化,信号稳定性相近,信号半衰期大于7小时。
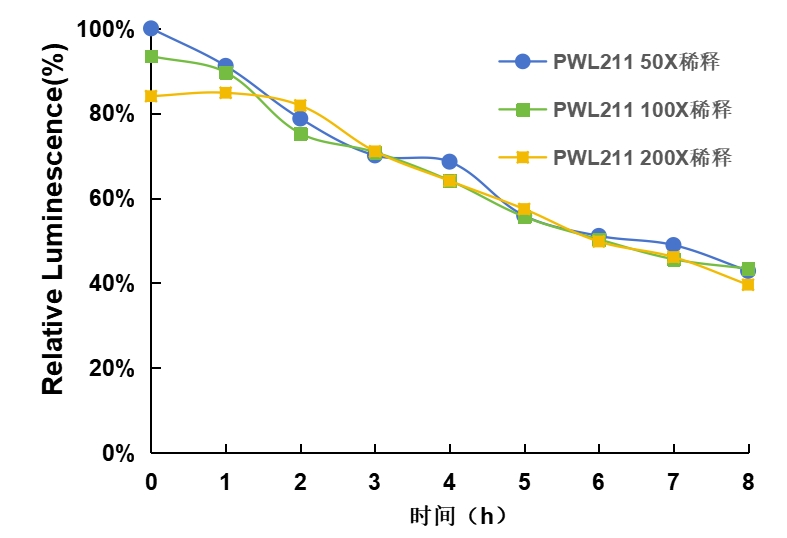
图4. Gaussia萤光素酶不同浓度稀释后检测对比图

